單細胞組織應力應變及特性測試分析系統,單細胞應力應變儀系統,單細胞納米壓痕儀系統,單細胞機械力測試分析儀,Piuma Chiaro單細胞組織應力應變及特性測試分析系統,單細胞應力應變儀系統,單細胞納米壓痕儀系統
|
美國Flexcellint國際公司,成立于1987年,該公司專注于細胞力學培養產品的設計和制造。以提供獨特的體外細胞拉應力、壓應力和流體剪切應力加載刺激系統以及配套的培養板、硅膠膜載片等耗材聞名于世。
Flexcell細胞組織力學培養系統不僅能對各種2D、3D細胞組織提供拉應力、壓應力、切應力刺激加載,而且還可以提供拉應力和切應力混合力同時加載;不僅能對細胞組織進行機械力加載刺激,而且還能進行三維培養、人工生物組織構建、動力模擬;不僅能單軸向牽張拉伸,而且還可以雙軸向牽張拉伸。 Flexcell獨具的StageFlexer拉應力顯微設備、StagePresser壓應力顯微設備、Flex Flow切應力顯微設備,可在加力培養的同時實時觀察研究細胞組織在力作用下的反應變化;獨具的flexstop隔離閥能使同一塊培養板里的細胞組織一部分受力,一部分不受力,方便進行對比實驗 這些系統智能、精準誘導來自各種細胞、組織在拉應力、壓應力和流體切應力作用下發生的生化生理變化,專業、細膩的闡釋了體外細胞、組織機械力刺激加載、力學信號感受和響應機制。對研究細胞的形態結構及功能,細胞的生長、發育、成熟、增殖、衰老、凋亡、死亡及癌變以及通路表達,細胞信號傳導及基因表達的調控,細胞的分化及其調控機理具有重要意義。
細胞組織應力背景與作用
應力信號協同生物化學信號是生物自適應結構自我設計和調控長成的設計和調控者,細胞核是細胞代謝活動的控制中心,指揮它的活動除了遺傳密碼外主要是外部刺激傳來的信號。細胞處于組織的應力環境中,應力刺激細胞膜并通過微絲和微管傳遞到細胞核,應力信號在傳遞過程中引起一系列生化反應。*新研究成果已證明應力信號與化學信號在決定細胞活動中具有同等重要性,應力信號在調控細胞的分化、生長和凋亡中起著主導作用。應力刺激按作用方向分為張應力、壓應力和切應力(血流對管壁)等,按時間分為定常和脈動應力。
系統基本原理(負氣壓交換模式):
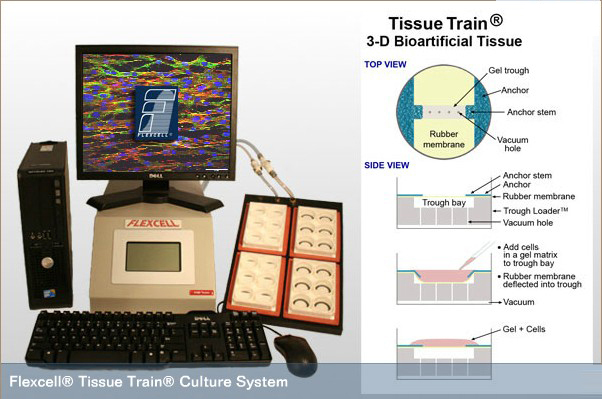
橡膠密封墊在細胞培養板基底膜與基板之間形成封閉腔,把此密封腔的進、出氣管插入二氧化碳培養箱里,把此密封腔放入二氧化碳培養箱, 利用封閉腔抽真空產生的負壓使彈性基底膜(拉動三維支架)發生形變,通過計算機控制系統調節氣體的壓力來改變基底膜的形變量,進而使貼壁生長的細胞受到牽拉加載刺激。
亮點: 17)典型應用: 該系統感應各種細胞在應力刺激下的生物化學反應,例如:骨骼細胞,肺細胞,心肌細胞,血細胞,皮膚細胞,肌腱細胞,韌帶細胞,軟骨細胞和骨細胞等各種2D或3D細胞組織。 典型應用科室:
18)系統具有模塊化易升級,可擴展兼備壓力加載、流體切應力加載、三維細胞組織培養功能。 19)系統可以和BioFlex雙向拉應力培養板, Uniflex單向拉應力培養板 、TissueTrain三維細胞組織培養板等系列細胞培養一起使用, 培養板類型、包被表面材料豐富:Amino, Collagen (Type I or IV), Elastin, ProNectin (R GD), Laminin (YIGSR).表面涂層豐富的 包被材料, 您可以跟根據不同細胞組織可以靈活選擇不同包被材料表面 (包被材料選擇參考)。
1、BioFLEX®雙向應力細胞培養板(BioFLEX®CULTURE PLATES)
2、UniFlex?單向應力細胞培養板(UniFlex?Culture Plates)
22)FX-5000T細胞牽張拉伸應力加載系統組成: 2、FX-5000C細胞壓力加載系統(flexcell FX5000 Compression system)——提供樣機體驗
系統基本原理(正氣壓交換模式):
利用橡膠密封墊在細胞培養板基底膜與基座之間形成封閉腔,把此密封腔的進、出氣管插入二氧化碳培養箱里,把此密封腔放入二氧化碳培養箱,利用封閉腔正氣壓擠壓培養孔里的活塞,進而使活塞和固定臺之間的凝膠三維培養物間接受到壓力發生形變,通過計算機控制系統調節氣體的壓力來改變基底膜的形變量。
(注釋:壓力加載培養板每個培養孔里都有一對活塞或固定臺)
亮點
1)該系統對各種組織、三維細胞培養物提供周期性或靜態的壓力加載;
5)同時兼備多通道細胞牽拉力加載功能;
6)多達4通道,可4個不同程序同時運行,進行多個不同壓力形變率對比實驗;
7)同一程序中可以運行多種頻率(0.01- 5 Hz),多種振幅和多種波形;8)更好地控制在超低或超高應力下的波形; 9)多種波形種類:靜態波形、正旋波形、心動波形、三角波形、矩形以及各種特制波形; 10)電腦系統對壓力加載周期、大小、頻率、持續時間**智能調控 11)壓力范圍:0.1 - 14磅,夾在活塞和固定臺之間的BioPress細胞培養板可承受正壓力的*大值為14磅,*小值為0.1磅。 12)典型應用科室: 檢測各種三維細胞組織在壓力作用下的生物變化、反應, 例如:軟骨組織,椎間盤骨組織,肌腱組織,韌帶組織,以及從肌肉,肺,心臟,血管,皮膚,肌腱,韌帶,軟骨和骨中分離出來的細胞。 13)在智能電腦主機的控制下,壓力傳導儀內的密封閥門裝置自動調節和控制壓力。 14)系統具有模塊化易升級,可擴展拉應力加載、流利切應力加載、三維細胞組織培養功能。具有細胞組織力學所要求的所有類型:牽張拉伸力、壓力、流體切應力加載刺激功能。 15)通過StagePress顯微壓應力加載設備,實時觀察細胞、組織在拉/壓應力作用下的反應 16)FX-5000C細胞組織壓應力加載系統組成:
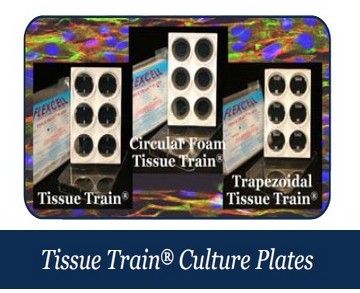
3、全自動可牽張拉伸刺激立體水凝膠支架三維細胞培養系統(Flexcell TissueTrain System)——提供樣機體驗
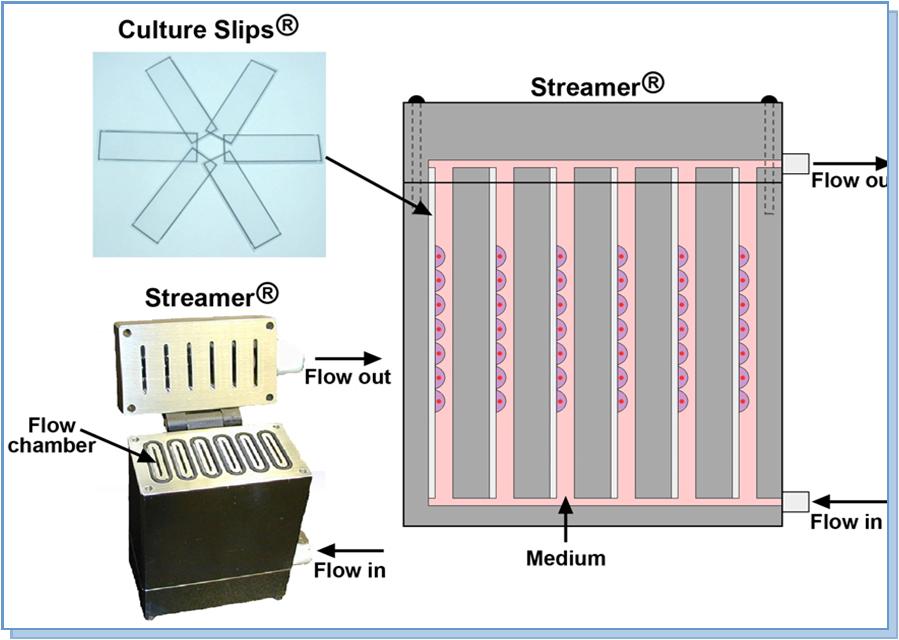
4.1、STR-4000六通道流體切應力加載分析設備
Streamer System系統包括: 1)Streamer設備; 2)預裝Streamer控制軟件的計算機; 3)快拆接頭及膠管; 4)蠕動泵; 5)StreamSoft軟件; 6)2個液流脈沖阻尼器; 7)12個細胞培養載片(Culture Slip) 細胞培養載片包括顯微鏡載(物)片和蓋玻片兩種產品,表面經過特殊處理,適合于細胞的貼壁與生長。 兩種規格:75 mm x 25 mm x 1.0 mm ,75 mm x 24 mm x 0.2 mm 。 75 mm x 25 mm x 1.0 mm 細胞培養載片的邊緣涂有1.0 mm寬的特氟隆邊框(Teflon),可以有效控制細胞生長在切應力加載區域。 自身熒光低,光學性能佳。 不同包被的培養表面提高細胞的貼壁與生長。 五種不同包被的培養表面:Amino, Collagen (Type I or IV) Elastin, ProNectin (RGD), Laminin (YIGSR). 所以產品都是無菌獨立包裝,僅供一次性使用。 訂貨信息(請聯系世聯博研公司) 75mm x 25mm x 1.0mm 和 Streamer 或者 FlexFlow 配套使用 產品編號 英文名稱 CS-U Culture Slips — Untreated CS-A Culture Slips — Amino CS-C Culture Slips — Collagen Type I CS-C(IV) Culture Slips — Collagen Type IV CS-E Culture Slips — Elastin CS-P Culture Slips — ProNectin CS-L Culture Slips — Laminin 75mm x 24mm x 0.2mm 和 FlexFlow配套使用 產品編號 英文名稱 FFCS-U Culture Slips — Untreated FFCS-A Culture Slips — Amino FFCS-C Culture Slips — Collagen Type I FFCS-C(IV) Culture Slips — Collagen Type IV FFCS-E Culture Slips — Elastin FFCS-P Culture Slips — ProNectin FFCS-L Culture Slips — Laminin 8)微流納流HiQ Flowmat |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Piuma Chiaro單細胞及組織力學性質測量儀
—將您的顯微鏡迅速升級為細胞力學測試系統

系統亮點概述
Piuma Chiaro是專門為單細胞、生物組織、人工組織的機械性能測試量身定做的儀器。可以安裝在實驗室現有的顯微鏡平臺上,快速提升顯微鏡的功能。其壓痕的探測范圍跨越幾個數量級別, 覆蓋單細胞、組織工程學和組織分類學中的所有測試尺度。
- 功能強大,實用可靠,可以對細胞的楊氏模量、硬度、剛度和粘彈性進行測量
- 可以進行非破壞性的機械測試
- 界面友好,可以對組織外植體和體外培養的組織工程評估生物組織力學性質。
- 測試楊氏模量范圍從100Pa到1GPa
- 可換探頭壓痕深度從 100nm到300um
- 可以在液體和凝膠中測試
- 有一個較大的掃描行程
Piuma Chiaro 系統適應性強
- 適用于任何型號的顯微鏡
- 使用**設計的FIBER TOP技術進行測量
- 安裝并使用一個非常敏感的測量探頭
- 探頭可以進行X-Y軸移動,可以對一個樣品進行網格式多點測量
- 手動操作可以粗調和細調定位
- Piuma Chiaro納米壓痕模塊可以安裝在任何顯微鏡上,對于細胞水平的樣品可以進行非常**的測量。
- Piuma Chiaro使得單細胞壓痕測量變得非常容易!系統還可在液體中測量,這對于一些模擬細胞所在的真實生理環境非常重要。
Piuma Chiaro 主要應用領域
細胞和生物軟組織的力學參數是一項至關重要的參數,如很多**都能引起細胞、軟組織硬度、楊氏模量的變化,如果能夠測得細胞和軟組織的力學參數,則可以預測病變的發生。

應用課題延伸領域分布
- 高血壓心肌肥厚狀態下心肌細胞微尺度剛度變化
- 測量大鼠心肌梗死心肌細胞的楊氏模量
- 單細胞水平黃芪多糖對肝竇內皮細胞微區力學影響
- 乳腺癌細胞的力學性質研究
- 研究***對細胞形貌和力學性質的影響
- 研究殼聚糖膜對細胞彈性的影響
- 重離子束和X射線輻照對Tca-8113細胞遷移侵襲及生物力學的影響
- 重離子和X射線輻照對皮質神經元細胞骨架及細胞力學性能的影響
- 間充質干細胞對肝腫瘤細胞力生物學行為的影響
- 牙周膜成纖維細胞彈性模量與內**作用關系
- 急性分離平滑肌細胞進行高分辨成像及微觀力學研究
- 姜黃素誘導人肝癌HepG2細胞凋亡的研究
- 基底/細胞系統剛度對肝細胞和肝癌細胞遷移的調節作用
- 前列腺癌生物力學性質的改變與其細胞惡性表型相關性的實驗研究
- **形態結構及其生物力學研究
- 紅細胞及不同侵襲程度癌細胞的成像及機械特性測量
- 缺氧大鼠心肌母細胞的楊氏模量
- 心肌纖維與Ⅰ型膠原纖維的超微結構及生物力學特性研究
- 宮頸癌細胞表面形貌與力學特性的研究
延伸應用課題
- 組織工程中軟骨細胞力學性能及與材料作用單細胞研究
- 植物的細胞力學行為研究及在***械損傷研究中的應用
- 紅細胞及不同侵襲程度癌細胞的成像及機械特性測量
- 單細胞水平黃芪多糖對肝竇內皮細胞微區力學影響的研究
- 粘彈性細胞模型及其力學特性的有限元分析
- 正常及神經管畸形小鼠神經上皮細胞力學特性的研究
- ****LHRH-PE40對HeLa細胞表面硬度的影響
- 豬卵母細胞透明帶彈性系數楊氏模量測定
- 軟組織的楊氏模量測量
- 熱刺激作用下血管內皮細胞形態及膜彈性變化
- 人多形核白細胞彈性測試
- 紅細胞變形性測試
- 細胞流變學測量芯片系統的素研究
- 水凝膠力學性質測試
- 人工三維打印組織測試
Piuma 細胞、軟生物組織機械力特性測量測試納米壓痕系統
Piuma Nanoindenter
Nanoindentation for tissue engineering
Map the mechanical properties of tissues andcells in just one click!
能夠**測量*低硬度的生物組織組織(比如胚胎)的機械特性 , 可以液體中很好地測試軟組織的楊氏模量 .
原理:利用光和微觀納米技術進行納米壓痕和繪制*柔軟樣品,測量細胞組織的機械特性
生物軟組織(包括皮膚、血管、肌肉、肌腱韌帶及各種器官等)的楊氏模量是一項至關重要的參數,很**都能引起生物軟組織的楊氏模量
變化,如果能夠測得生物軟組織的楊氏模量,側可以預測病變發生。正常組織與病變組織的楊氏模量—形變曲線之間也存在差異。
楊氏模量是反應物質本身彈性性質的物理量,研究表明,生物組織的病理變化都往往導致組織的彈性性質的變化。癌癥通常變現為*硬的結塊;脂肪或膠原的沉積,增加或較少了組織彈性,導致**。
納米壓痕技術是細胞組織粘附特性、彈性特性、硬度和彈性模變量的有力工具 , 該系統是目前世界上***的細胞組織納米力學性能測試 儀器 ,可測定骨、牙齒或細胞等生物組織分層力學特性 .
對生理狀態下的活細胞進行壓痕實驗 , 得到了癌細胞表面彈性特性和粘附特性 , 并對癌細胞與正常細胞彈性特性和粘附特性進行了對比分析。根據細胞彈性模量和粘附力的大小可以進行癌癥診斷 , 為癌癥的診斷提供了新途徑
測試的組織和細胞的機械性質 , 只需輕點一下鼠標!
Piuma 生物納米壓痕 — 為生物組織工程設計的納米壓痕儀
· 我設計的樣品符合原生的組織樣品的機械性能測試嗎 ?
· 我的樣品在納觀 , 微觀和宏觀上的機械性能互相相關嗎 ?
· 為什么一定的外界條件(如脫水),能*大地改變某些組織的機械特性?
· 如何測試非均勻樣品上點對點的粘彈性性質的變化?
像你一樣的研究者可以研究著細胞和組織的力學機械性能在再生醫學和樣品分類中,因此Optics11公司設計了Piuma,一種**性的簡單易用的可以給納米和微觀的組織機械性能測試帶來光明的納米壓痕。
這個系統依靠一個**的微機械彈簧輕推小球壓入樣品。觀察樣品在溫和的壓力如何變形,該儀器在靜態載荷和動態操作能迅速提供的壓痕位置的所有的機械性能。

· 測試楊氏模量范圍從100Pa到1GPa
· 可換探頭從100nm到100um
· 可以在液體和凝膠中測試
· 有一個較大的掃描行程
· 可以在層流柜中使用
· 可以測試細胞外基質EMC的硬度
Piuma聯通了納米,微觀和宏觀的機械性能測試。壓頭尺寸可以變化放大幾個數量級別,可以覆蓋在組織工程學和組織分類學中所有的測試尺度.
只要插上探頭,使用內置的顯微鏡來選擇要對信息的區域,然后點擊開始按鈕。
在幾秒鐘內,你將對你的新樣品的機械性能有清醒的認識!
|
技術參數 |
|
|
楊氏模式 |
100 Pa–1 GPa |
|
準確度 / 精密 |
<30%/<10% |
|
壓痕針尖尺寸 |
100 nm–100 μm |
|
壓痕深度 |
可達 17 μm( 連續行程 ) 可達 12 mm(100nm 步進模式 ) |
|
壓痕動態范圍 |
~DC-1kHz( 連續行程 ) |
|
樣品臺移動范圍 |
12x12mm 2 |
|
*小點至點間距 |
<1μm |
|
柵格測繪速度 |
樣品粘彈性限制 (高達 1 點 / 秒) |
|
樣品的溫度穩定性(可選) |
<0.5 °C |
|
內置顯微鏡的放大倍數 |
20x |
|
外形尺寸 |
測試設置 :100x100x200mm 3 電子設備 :215x200x170mm 3 |
德國cellastix高通量單細胞 力學特性表征測量系統
產品詳細信息
單細胞高通量細胞激光牽張拉伸應力加載與力學屬性分析系統
Optical Stretcher是用于細胞生物力學高通量測量研究的激光光學牽張拉伸**平臺技術。
****臺用來高通量測量單個懸浮細胞(懸液細胞)的變形能力設備。
該激光光學牽張拉伸器是個可以安裝在任何相位差顯微鏡上的模塊。溫度穩定和激光**的顯微鏡系統。
Optical Stretcher 
**研究(Innovation in Research)
Optical Stretcher激光光學牽張拉伸器是一種新穎的用來測量和分析單個懸液細胞生物力學特性(比如:如彈性和松弛)的激光工具。
非接觸式細胞形變(Contact-free cell deformation)
無接觸式細胞形變“開放=”0“的風格=”2“]是激光力引起的懸浮細胞形變,這決定**的無接觸式測量。這可確保均勻的細胞處理,避免因接觸引起的細胞反應文物。
高通量單細胞流變
通過集成的微流體系統可以很可以容易地測定300個細胞/小時。這樣就可以在**時間收集細胞流變顯著的統計數據
省時,自動測量(Timesaving, automated measurements)
對應于用戶定義的拉伸模式,細胞被自動傳送到測量區域進行形變。在光學拉伸加載運行實驗中,你可以專注于闡述實驗結果。
產品規格
-
包括有兩個壓力控制通道的微流體系統
-
*大每個光纖2功率W摻鐿光纖激光器
-
安裝倒置相差顯微鏡
-
激光**和溫度控制
-
可選用組合熒光顯微鏡
軟件規格
-
使用CellStretcher模塊控制所有組件和自動測量細胞
-
由CellEvaluator提取記錄顯微圖像形變數據
-
由CellReporter統計分析和可視化特性參數
-
為自己的統計分析訪問原始數據
產品特點:
-
非接觸式和無標記的細胞測量
-
高通量-250細胞/小時
-
省時的自動測量
-
模塊可以在任何倒置相差顯微鏡進行安裝
-
外殼激光**和穩定的溫度
-
數據評估軟件
產品規格:
Fibolux laser system 2 W
reliable microfluidic system for easy probe handling
尺寸 cm (w x h x d): 70 x 80 x 100
Options
combination with fluorescence microscopy

技術
optical stretcher 是一種新穎的微操縱單個生物細胞激光工具,探討在懸浮液的粘彈性性質[1]。



通過兩個對立的激光束鉗持一個細胞,進行牽張拉伸細胞兩邊。更高的激光功率使細胞發生形變。
細胞的形變是由CCD相機記錄,并由一專門設計的軟件進行評估。
Optical Stretcher 測量室集成有微流系統,使得細胞容易地一個接一個地輸送
可以達到每小時約250個細胞的高吞吐率,允許相對于其它工具,例如原子力顯微鏡(AFM)更好的統計信息。


Momentum transfer at the cell surface
Cell mechanics as a disease marker
The physical mechanics of cells are important for their regular, biological functioning and are regulated by a structure called the cytoskeleton. It is involved in many vital processes of the cell. If these are changes this naturally results also in changes of the biomechanical properties, which can be measured with the Optical Stretcher. There is already published data for cancer [2, 3] and for the effect of cell aging [4].
Several ongoing studies examine the ability of the Optical Stretcher to differentiate between the stages of a cancer tumor, making it a valuable tool for both scientific research and clinical diagnosis [5].

Cell types can be differentiated by their deformation in the optical stretcher
細胞形變力源自激光。當光被折射在細胞表面存在的光子的動量的變化。因為整體動量必須始終保守有一個在垂直于作用于它的力形式的動量轉移到細胞表面。
Research
Our device allows various applications in basic research of biophysics, biology & medicine.
Industry
Due to the high-throughput the Optical Stretcher is suitable for industrial drug-screening.
Clinical Diagnostic
First clinical trials with breast cancer tumors show a different deformation of cancerous cells.

應用:
生物物理研究(Biophysical Research)
Characterization of fundamental cytoskeletal functions and processes in eukaryotic cells
**篩選(Drug Screening)
Testing new substances and their efficiency on a cellular basis
Aging proscesses
Identification of markers for cell aging and testing of anti-aging substances
干細胞分化(Differentiation)
Utilization of cell stiffness as a marker for differentiation processes in stem cells
Immune response
Investigation of cytoskeletal changes of immune-activated cells
Mechanisms of diseases
New insight in cellular changes caused by diseases such as cancer, malaria or sepsis
Publications
Optical Stretcher Technology
Lincoln, B., Schinkinger, S., Travis, K., Wottawah, F., Ebert, S., Sauer, F., Guck, J., 2007. Reconfigurable microfluidic integration of a dual-beam laser trap with biomedical applications. Biomed. Microdevices 9, 703–710. doi:10.1007/s10544-007-9079-x
Ebert, S., Travis, K., Lincoln, B., Guck, J., 2007. Fluorescence ratio thermometry in a microfluidic dual-beam laser trap.Opt. Express 15, 15493–15499. doi:10.1364/OE.15.015493
Jensen-McMullin, C., Lee, H.P., Lyons, E.R.L., 2005. Demonstration of trapping, motion control, sensing and fluorescence detection of polystyrene beads in a multi-fiber optical trap. Opt. Express 13, 2634–2642. doi:10.1364/OPEX.13.002634
Wottawah, F., Schinkinger, S., Lincoln, B., Ananthakrishnan, R., Romeyke, M., Guck, J., K?s, J., 2005.Optical Rheology of Biological Cells. Phys. Rev. Lett. 94, 098103. doi:10.1103/PhysRevLett.94.098103
Lincoln, B., Erickson, H.M., Schinkinger, S., Wottawah, F., Mitchell, D., Ulvick, S., Bilby, C., Guck, J., 2004. Deformability-based flow cytometry.Cytometry A 59A, 203–209. doi:10.1002/cyto.a.20050
Theoretical Models
Ananthakrishnan, R., Guck, J., Wottawah, F., Schinkinger, S., Lincoln, B., Romeyke, M., Kas, J., 2005. Modelling the structural response of an eukaryotic cell in the optical stretcher. Curr. Sci. 88.
B. Bareil, P., Sheng, Y., Chiou, A., 2006. Local scattering stress distribution on surface of a spherical cell in optical stretcher. Opt. Express 14, 12503–12509. doi:10.1364/OE.14.012503
Bareil, P.B., Sheng, Y., Chen, Y.-Q., Chiou, A., 2007. Calculation of spherical red blood cell deformation in a dual-beam optical stretcher. Opt. Express 15, 16029–16034. doi:10.1364/OE.15.016029
Boyde, L., Ekpenyong, A., Whyte, G., Guck, J., 2012. Comparison of stresses on homogeneous spheroids in the optical stretcher computed with geometrical optics and generalized Lorenz–Mie theory. Appl. Opt. 51, 7934–7944. doi:10.1364/AO.51.007934
Ekpenyong, A.E., Posey, C.L., Chaput, J.L., Burkart, A.K., Marquardt, M.M., Smith, T.J., Nichols, M.G., 2009. Determination of cell elasticity through hybrid ray optics and continuum mechanics modeling of cell deformation in the optical stretcher.Appl. Opt. 48, 6344–6354. doi:10.1364/AO.48.006344
Teo, S.-K., Goryachev, A.B., Parker, K.H., Chiam, K.-H., 2010. Cellular deformation and intracellular stress propagation during optical stretching. Phys. Rev. E 81, 051924. doi:10.1103/PhysRevE.81.051924
Cancer research and diagnostics
Martin, M., Müller, K., Cadenas, C., Hermes, M., Zink, M., Hengstler, J.G., K?s, J.A., 2012. ERBB2 overexpression triggers transient high mechanoactivity of breast tumor cells. Cytoskeleton 69, 267–277. doi:10.1002/cm.21023
Fritsch, A., H?ckel, M., Kiessling, T., Nnetu, K.D., Wetzel, F., Zink, M., K?s, J.A., 2010. Are biomechanical changes necessary for tumour progression?Nat. Phys. 6, 730–732. doi:10.1038/nphys1800
Brunner, C., Niendorf, A., K?s, J.A., 2009. Passive and active single-cell biomechanics: a new perspective in cancer diagnosis. Soft Matter 5, 2171–2178. doi:10.1039/B807545J
Remmerbach, T.W., Wottawah, F., Dietrich, J., Lincoln, B., Wittekind, C., Guck, J., 2009. Oral Cancer Diagnosis by Mechanical Phenotyping. Cancer Res. 69, 1728–1732. doi:10.1158/0008-5472.CAN-08-4073
Martin, M., Mueller, K., Wottawah, F., Schinkinger, S., Lincoln, B., Romeyke, M., K?s, J.A., 2006. Feeling with light for cancer. p. 60800P–60800P–10. doi:10.1117/12.637899
Guck, J., Schinkinger, S., Lincoln, B., Wottawah, F., Ebert, S., Romeyke, M., Lenz, D., Erickson, H.M., Ananthakrishnan, R., Mitchell, D., K?s, J., Ulvick, S., Bilby, C., 2005. Optical Deformability as an Inherent Cell Marker for Testing Malignant Transformation and Metastatic Competence. Biophys. J. 88, 3689–3698. doi:10.1529/biophysj.104.045476
Stem cell research
Ekpenyong, A.E., Whyte, G., Chalut, K., Pagliara, S., Lautenschlaeger, F., Fiddler, C., Paschke, S., Keyser, U.F., Chilvers, E.R., Guck, J., 2012.Viscoelastic Properties of Differentiating Blood Cells Are Fate- and Function-Dependent. Plos One 7, e45237. doi:10.1371/journal.pone.0045237
Galle, J., Bader, A., Hepp, P., Grill, W., Fuchs, B., Kas, J.A., Krinner, A., MarquaB, B., Muller, K., Schiller, J., Schulz, R.M., von Buttlar, M., von der Burg, E., Zscharnack, M., Loffler, M., 2010. Mesenchymal Stem Cells in Cartilage Repair: State of the Art and Methods to monitor Cell Growth, Differentiation and Cartilage Regeneration. Curr. Med. Chem. 17, 2274–2291. doi:10.2174/092986710791331095
Maloney, J.M., Nikova, D., Lautenschlager, F., Clarke, E., Langer, R., Guck, J., Van Vliet, K.J., 2010. Mesenchymal Stem Cell Mechanics from the Attached to the Suspended State. Biophys. J. 99, 2479–2487. doi:10.1016/j.bpj.2010.08.052
Lautenschl?ger, F., Paschke, S., Schinkinger, S., Bruel, A., Beil, M., Guck, J., 2009. The regulatory role of cell mechanics for migration of differentiating myeloid cells. Proc. Natl. Acad. Sci. 106, 15696–15701. doi:10.1073/pnas.0811261106
Basic research
Gyger, M., Stange, R., Kiessling, T.R., Fritsch, A., Kostelnik, K.B., Beck-Sickinger, A.G., Zink, M., Kaes, J.A., 2014. Active contractions in single suspended epithelial cells. Eur. Biophys. J. Biophys. Lett. 43, 11–23. doi:10.1007/s00249-013-0935-8
Seltmann, K., Fritsch, A.W., K?s, J.A., Magin, T.M., 2013. Keratins significantly contribute to cell stiffness and impact invasive behavior. Proc. Natl. Acad. Sci. 201310493. doi:10.1073/pnas.1310493110
Kie?ling, T.R., Stange, R., K?s, J.A., Fritsch, A.W., 2013. Thermorheology of living cells—impact of temperature variations on cell mechanics. New J. Phys. 15, 045026. doi:10.1088/1367-2630/15/4/045026
Kie?ling, T.R., Herrera, M., Nnetu, K.D., Balzer, E.M., Girvan, M., Fritsch, A.W., Martin, S.S., K?s, J.A., Losert, W., 2013. Analysis of multiple physical parameters for mechanical phenotyping of living cells. Eur. Biophys. J. 42, 383–394. doi:10.1007/s00249-013-0888-y
Paschke, S., Weidner, A.F., Paust, T., Marti, O., Beil, M., Ben-Chetrit, E., 2013. Technical advance: Inhibition of neutrophil chemotaxis by colchicine is modulated through viscoelastic properties of subcellular compartments. J. Leukoc. Biol. 94, 1091–1096. doi:10.1189/jlb.1012510
Chalut, K.J., H?pfler, M., Lautenschl?ger, F., Boyde, L., Chan, C.J., Ekpenyong, A., Martinez-Arias, A., Guck, J., 2012. Chromatin decondensation and nuclear softening accompany Nanog downregulation in embryonic stem cells. Biophys. J. 103, 2060–2070. doi:10.1016/j.bpj.2012.10.015
Matthews, H.K., Delabre, U., Rohn, J.L., Guck, J., Kunda, P., Baum, B., 2012. Changes in Ect2 localization couple actomyosin-dependent cell shape changes to mitotic progression. Dev. Cell 23, 371–383. doi:10.1016/j.devcel.2012.06.003
Mauritz, J.M.A., Esposito, A., Tiffert, T., Skepper, J.N., Warley, A., Yoon, Y.-Z., Cicuta, P., Lew, V.L., Guck, J.R., Kaminski, C.F., 2010. Biophotonic techniques for the study of malaria-infected red blood cells. Med. Biol. Eng. Comput. 48, 1055–1063. doi:10.1007/s11517-010-0668-0
Rusciano, G., 2010. Experimental analysis of Hb oxy–deoxy transition in single optically stretched red blood cells. Phys. Med. 26, 233–239. doi:10.1016/j.ejmp.2010.02.001
Aging processes
Schulze, C., Wetzel, F., Kueper, T., Malsen, A., Muhr, G., Jaspers, S., Blatt, T., Wittern, K.-P., Wenck, H., K?s, J.A., 2010.Stiffening of Human Skin Fibroblasts with Age. Biophys. J. 99, 2434–2442. doi:10.1016/j.bpj.2010.08.026
Vesicles
Solmaz, M.E., Sankhagowit, S., Biswas, R., Mejia, C.A., Povinelli, M.L., Malmstadt, N., 2013. Optical stretching as a tool to investigate the mechanical properties of lipid bilayers. Rsc Adv. 3, 16632–16638. doi:10.1039/c3ra42510j
Solmaz, M.E., Biswas, R., Sankhagowit, S., Thompson, J.R., Mejia, C.A., Malmstadt, N., Povinelli, M.L., 2012. Optical stretching of giant unilamellar vesicles with an integrated dual-beam optical trap. Biomed. Opt. Express 3, 2419–2427. doi:10.1364/BOE.3.002419
Technical advances
Bellini, N., Bragheri, F., Cristiani, I., Guck, J., Osellame, R., Whyte, G., 2012. Validation and perspectives of a femtosecond laser fabricated monolithic optical stretcher. Biomed. Opt. Express 3, 2658–2668. doi:10.1364/BOE.3.002658
Bellini, N., Vishnubhatla, K.C., Bragheri, F., Ferrara, L., Minzioni, P., Ramponi, R., Cristiani, I., Osellame, R., 2010.Femtosecond laser fabricated monolithic chip for optical trapping and stretching of single cells. Opt. Express 18, 4679–4688. doi:10.1364/OE.18.004679